01-09-2015
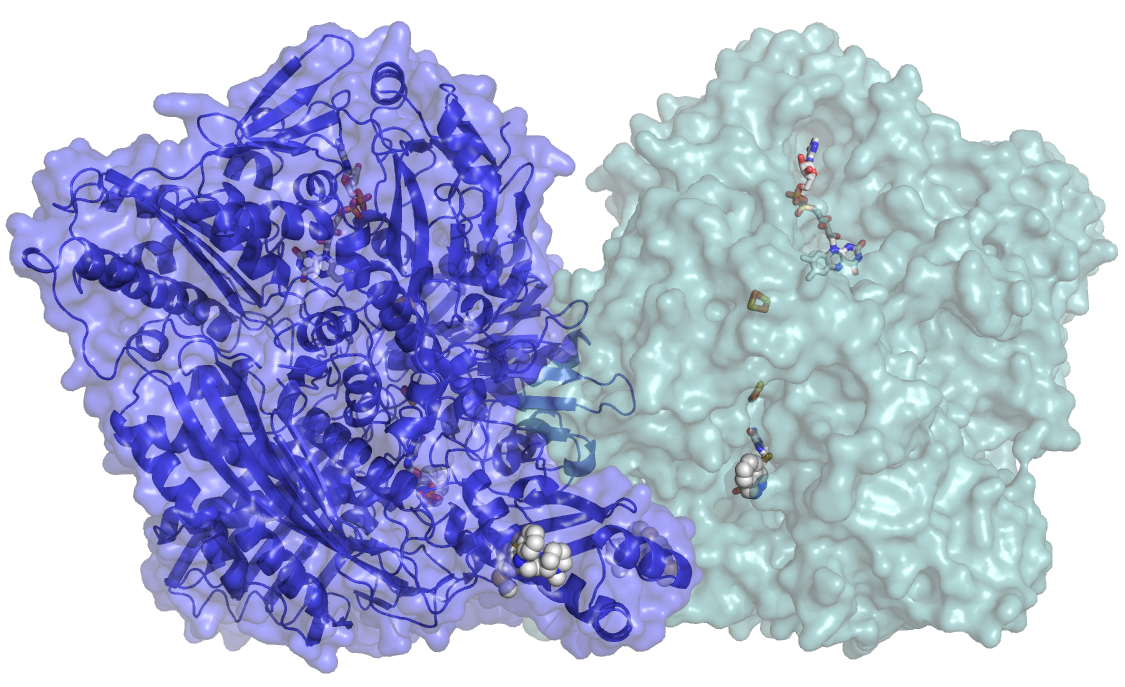
Catarina Coelho, Teresa Santos Silva e Maria João Romão do grupo de Cristalografia Macromolecular do Departamento de Química da FCT-NOVA cristalizaram e determinaram a estrutura 3D da proteína Aldeído Oxidase (AOX) humana após um processo longo e trabalhoso. Os resultados obtidos podem ser usados para otimizar estudos de desenvolvimento de fármacos tendo em vista a produção de melhores medicamentos num espaço de tempo mais curto e com menos falhas diminuindo assim o respetivo custo. Este trabalho foi realizado em colaboração com cientistas da Universidade de Potsdam na Alemanha e os resultados publicados a 31 de Agosto na Nature Chemical Biology.
Os enormes custos e esforços associados à investigação para a descoberta de novos fármacos têm um grande impacto na indústria farmacêutica, em particular devido à elevada taxa de fracasso nos ensaios clínicos. Uma das razões para o insucesso de tais ensaios nos quais se testam novas moléculas alvo, é a respetiva modificação enzimática não específica. A AOX é uma enzima cuja participação no metabolismo de fármacos tem um grande impacto no processo de desenvolvimento de novos medicamentos o que justifica o enorme interesse da indústria farmacêutica na AOX. Esta enzima está presente no fígado e metaboliza de modo não específico uma grande variedade de fármacos e compostos xenobióticos. Como consequência direta, e no âmbito do desenvolvimento de fármacos, torna-se difícil prever se novas moléculas poderão vir a ser metabolizadas pela AOX, conduzindo ao insucesso de estudos pré-clínicos. Além disso, o número de enzimas do tipo AOX difere consoante a espécie: enquanto os humanos possuem apenas uma forma, os roedores expressam 4 formas da enzima, não existindo um modelo animal adequado que permita prever o metabolismo pela AOX de novos potenciais fármacos antes de se prosseguir com ensaios clínicos.
“Neste trabalho conseguimos cristalizar e determinar a estrutura 3D da AOX humana o que permitiu compreender a respetiva ação catalítica e modo de inibição. Esta informação irá contribuir para melhorar o processo de desenho de fármacos, permitindo que as farmacêuticas possam desenvolver métodos in silico de previsão do metabolismo pela AOX. Este é um passo crucial para guiar a descoberta de fármacos e avaliar a farmacocinética nos ensaios clínicos”, explica Maria João Romão, responsável pelo grupo de Cristalografia Macromolecular da FCT‐NOVA e Diretora da Unidade de Investigação UCIBIO. O conhecimento da estrutura 3D da enzima permitirá ainda compreender a existência de polimorfismos de nucleótido simples (SNP) na enzima humana, os quais, apesar de silenciosos, podem ter consequências importantes no metabolismo do fígado.
A proteína completa possui mais de 1330 aminoácidos (mais do que 10 mil átomos). Devido o seu grande tamanho, usámos a Cristalografia de Raios‐X para determinar a estrutura 3D da enzima e poder “ver” o complicado arranjo dos aminoácidos entre si. Apenas quando conseguimos localizar as posições da maioria dos mais de 10 mil átomos é que pudemos correlacionar a estrutura com a função e tirar conclusões acerca dos mecanismos enzimáticos e de inibição”, explica Catarina Coelho, investigadora pós‐doc na FCT‐NOVA e primeira autora do artigo. O grupo de Cristalografia Macromolecular trabalha na enzima AOX desde há 8 anos, tendo os primeiros estudos sido focados na enzima de rato, de que resultaram várias publicações, entre as quais a estrutura cristalina no Journal of Biological Chemistry, em 2012. A AOX humana possui cofactores metálicos complexos (contendo molibdénio e ferro) que não são facilmente sintetizados em bactérias tais como a Escherichia coli, o organismo escolhido para a produção de quantidades suficientes da proteína. Foi por isso necessário desenvolver um sistema especial, em colaboração com cientistas da Universidade de Potsdam, para que se pudesse produzir a proteína em quantidade suficiente e com o grau de pureza necessário. Em cristalografia de proteínas, “o bottleneck (passo limitante) é a obtenção de cristais adequados; a experiência que ganhámos com a proteína AOX de rato permitiu-nos o início dos trabalhos com a proteína humana”, explica Maria João Romão.

Para se poder determinar a estrutura da AOX, mais do que 800 cristais tiveram que ser medidos em diversos laboratórios de radiação de sincrotrão: ESRF em França, DLS no Reino Unido e SLS na Suíça. Durante os últimos quatro anos, “precisámos de mais de 40 viagens até ao Sincrotrão e de muitas noites em claro até que obtivéssemos dados de boa qualidade dos cristais da AOX”, refere Catarina Coelho e Teresa Santos-Silva, Investigadora FCT (IF) e coautora do artigo. Como resultado destas experiências, as autoras puderam determinar a estrutura da enzima nativa assim como a de um complexo com um antipsicótico (tioridazina). “Os dados que obtivemos revelaram um novo local de ligação que pode ter um carácter geral para outros fármacos análogos”, explica Teresa Santos-Silva, e “os principais resultados descritos na nossa publicação permitirão, num futuro próximo, desenvolver novos inibidores e desenhar fármacos resistentes ao metabolismo pela AOX, ajudando desse modo a reduzir as taxas de insucesso em ensaios clínicos”.

Mais notícias: